高考化学考点解读——非金属元素单质及其重要化合物
来源:未知发布时间:2017-06-21
高考频度:★★★★★ 难易程度:★★★☆☆
A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是
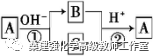
A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
【参考答案】D
【试题解析】A为S(或Cl2),在碱性条件下,发生歧化反应生成 和S2?(或ClO?和Cl?),这两者在酸性条件下,发生归中反应生成S(或Cl2),A为单质,所以反应①和②一定为氧化还原反应,由于反应①和②的条件不同,所以不是可逆反应。
和S2?(或ClO?和Cl?),这两者在酸性条件下,发生归中反应生成S(或Cl2),A为单质,所以反应①和②一定为氧化还原反应,由于反应①和②的条件不同,所以不是可逆反应。
1.碳、硅及其重要化合物性质误区
(1)非金属单质与碱液反应一般无 H2 放出,但 Si 能与碱液反应放出 H2。
(2)二氧化硅与氢氟酸反应是二氧化硅的特性,但二氧化硅不是两性氧化物。
(3)H2CO3的酸性大于H2SiO3的,所以有 Na2SiO3+CO2(少量)+H2O===H2SiO3↓+Na2CO3,但高温下Na2CO3+SiO2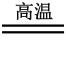 Na2SiO3+CO2↑也能发生,原因可以从两方面解释:①硅酸盐比碳酸盐稳定;②从化学平衡角度,由高沸点难挥发固体SiO2制得低沸点易挥发的CO2。
Na2SiO3+CO2↑也能发生,原因可以从两方面解释:①硅酸盐比碳酸盐稳定;②从化学平衡角度,由高沸点难挥发固体SiO2制得低沸点易挥发的CO2。
(4)SiO2不导电,是制作光导纤维的材料;Si是半导体,是制作光电池的材料。
(5)水泥、玻璃与陶瓷是三大传统无机非金属材料,碳化硅、氮化硅等是新型无机非金属材料。
2.氮及其化合物六大“思维盲点”
(1)NO只能用排水法或气囊法收集,NO2不能用排水法,可用排苯法收集。
(2)工业上制备的盐酸显黄色是因为溶有Fe3+,而浓HNO3显黄色是因为溶有NO2。
(3)NO2能被NaOH溶液吸收,NO单独不能被强碱溶液吸收,NO与NO2混合能被NaOH溶液吸收。
(4)实验室制备NH3,除了用Ca(OH)2和NH4Cl反应外,还可用浓氨水的分解(加NaOH固体或CaO)制取,而检验 须用浓NaOH溶液并加热,用湿润的红色石蕊试纸检验生成的气体,以确定
须用浓NaOH溶液并加热,用湿润的红色石蕊试纸检验生成的气体,以确定 的存在。
的存在。
(5)收集NH3时,把一团干燥的棉花放在试管口,以防止与空气对流;收集完毕,尾气处理时,应放一团用稀硫酸浸湿的棉花在试管口,以吸收NH3。
(6)浓盐酸和浓氨水反应有白烟生成,常用于HCl和NH3的相互检验。
1.将0.4 mol混合气体(混合气体中甲、乙的体积比为1∶1)通入50 mL 1 mol·L?1的丙溶液中,无沉淀产生的是
选项
甲
乙
丙
A
Cl2
SO2
Ba(NO3)2
B
HCl
CO2
Ca(OH)2
C
NH3
SO2
Ba(OH)2
D
NO2
SO2
BaCl2
2.下列化学实验事实及其结论都正确的是
选项
实验事实
结 论
A
将SO2通入含HClO的溶液中生成H2SO4
HClO的酸性比H2SO4强
B
浓硝酸使紫色石蕊试液先变红后褪色
浓硝酸体现酸性和强氧化性
C
NO2可以与NaOH溶液反应
NO2是酸性氧化物
D
将SO2通入溴水中,溴水褪色
SO2具有漂白性
3.某同学在常温下设计以下实验流程探究Na2S2O3的化学性质。
pH=8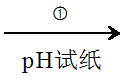 Na2S2O3溶液
Na2S2O3溶液 白色沉淀B
白色沉淀B
下列说法正确的是
A.实验①说明Na2S2O3溶液中水电离的c(OH?)=10?8 mol·L?1
B.Na2S2O3溶液pH=8的原因用离子方程式表示为 +2H2O
+2H2O H2S2O3+2OH?
H2S2O3+2OH?
C.生成的沉淀B可能是BaSO3或BaSO4,要进一步确认还需加入稀硝酸验证
D.实验②说明Na2S2O3具有还原性
1.【答案】B
【解析】向硝酸钡溶液中通入氯气、二氧化硫,会生成硫酸钡沉淀,A项不符合题意;n(HCl)=0.2 mol,n(CO2)=0.2 mol,n[Ca(OH)2]=0.05 mol,HCl先与Ca(OH)2反应,且HCl过量,生成的CaCl2与CO2不反应,B项符合题意;NH3与SO2通入Ba(OH)2溶液中,会生成亚硫酸钡沉淀,C项不符合题意;NO2与SO2通入BaCl2溶液中,最终会生成硫酸钡沉淀,D项不符合题意。
2.【答案】B
【解析】选SO2通入含HClO的溶液,会发生如下反应:SO2+HClO+H2O 3H++
3H++ +Cl?,A错误;与碱发生复分解反应生成盐和水的氧化物是酸性氧化物,NO2与NaOH的反应是氧化还原反应,C错误;溴具有氧化性、二氧化硫具有还原性,二者发生氧化还原反应从而使溴水颜色褪去,通常SO2的漂白性是指使品红溶液褪色,D错误。
+Cl?,A错误;与碱发生复分解反应生成盐和水的氧化物是酸性氧化物,NO2与NaOH的反应是氧化还原反应,C错误;溴具有氧化性、二氧化硫具有还原性,二者发生氧化还原反应从而使溴水颜色褪去,通常SO2的漂白性是指使品红溶液褪色,D错误。
3.【答案】D
【解析】Na2S2O3溶液的pH=8,说明 水解,水的电离受到促进,由水电离的c(OH?)=1×10?6 mol·L?1,A项错误;
水解,水的电离受到促进,由水电离的c(OH?)=1×10?6 mol·L?1,A项错误; 水解是分步进行的,B项错误;因为氯水具有强氧化性,与Na2S2O3发生氧化还原反应,且氯水足量,故白色沉淀B中一定没有BaSO3,只有BaSO4,故C项错误;D项正确。
水解是分步进行的,B项错误;因为氯水具有强氧化性,与Na2S2O3发生氧化还原反应,且氯水足量,故白色沉淀B中一定没有BaSO3,只有BaSO4,故C项错误;D项正确。
更多精彩文章
- 高二化学||化学反应速率与化学平衡类试题的解题方法与技巧
- 高考化学:可逆反应与化学平衡状态(重点)
- 有关过氧化钠与二氧化碳、水的反应
- 离子反应与离子共存知识点总结
- 高考化学 | 化学反应速率知识汇总
- 【知识点】“化学反应速率和化学平衡”知识点归纳
- 【知识点】高考化学考点:分散系、胶体与溶液的概念及关系
- 【涨知识】化学党能活着简直不容易!10个经典的爆炸化学反应
- 【知识点】高考化学反应速率、化学平衡汇总,速来抱走!
- 高中化学:详细知识点汇总【考试通用版】
- 3大技巧让你高考化学选择题正确率飙升!
- 高中化学学习指导:寒暑假是学习的重要环节
- 高三化学复习方法与策略
- 高考化学复习善用总结归纳法
- 良好的学习习惯是学好化学的关键